MDR İşlemleri
5 Önemli Ayrıntı
MDR İşlemleri, Giriş: AB MDR Tıbbi Cihaz Etiketleme Düzenlemeleri
Bu yazı, AB Tıbbi Cihaz Yönetmeliği (MDR) 2017/745 kapsamındaki tıbbi cihaz etiketleme ve kullanım kılavuzu düzenlemelerini konu almaktadır.
Takvimler 6 Mayıs 2021´yi gösterdiğinde, 2017/745 Sayılı AB Tıbbî Cihaz Yönetmeliği (MDR) 93/42/EEC Sayılı AB Tıbbi Cihaz Direktifinin (MDD) yerini alarak, halk sağlığı ve güvenliğinin daha iyi korunmasına yönelik bir tüzel çerçeve oluşturacak. AB MDR 2017/745 tıbbi cihazların onaylanmasıyla ilgili şartların kapsamını genişletmekte ve ürünlerin tasarım ve üretiminde kullanılan maddelere tüketiciye yönelen olası riskin azaltılması maksadıyla ek sınırlamalar getirmekte. Bu yeni yönetmelik, belirli bir eşiğin üzerinde mutajenik, kanserojen veya üreme zehirliliği olduğu bilinen maddelerin yanı sıra endokrin bozucu özelliklere sahip olduğu bilinen maddelerin bazılarının kullanımını kısıtlıyor.
Bu kapsama giren, kısıtlı maddeler içeren tıbbi cihazların genel tıbbi cihaz etiketleme kriterlerinin yanı sıra ihtiyaca uygun özel etiketler ve ihtiyati talimatlar taşıması zorunlu hale geliyor. AB MDR´ ne aykırılık hallerinde, aykırı ürün için toplatma, para cezaları ve hatta AB pazarına erişimden men gibi yaptırımlar öngörülüyor.
Buradan hareketle, MDR 2017/745 kapsamındaki tıbbi cihazlar için genel etiket ve kullanım kılavuzu düzenlemeleri neymiş, bir bakalım. İzleyen bölümlerde bu düzenlemelere tabi olan ürünlerle ilgili bilgi de verilmektedir.
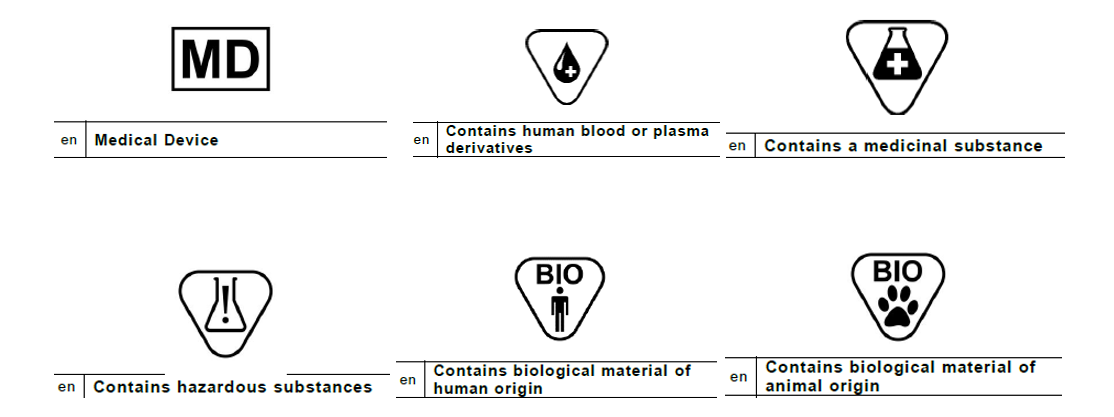
Ürün Etiketleme ve Kullanma Talimatına İlişkin AB MDR Düzenlemeleri
Tıbbi cihaz üreticilerinin cihazları beraberinde verilen bilgilerle ilgili bazı şartları karşılaması gerekiyor. Örnek olarak, her tıbbi cihaz beraberinde cihazı ve üreticisini açıkça tanımlamak için gerekli olan ve kullanıcıya kendisiyle ilgili varsa verilmesi gereken güvenlik ve performansa ilişkin bilgiler verilmesi zorunlu. Bu gibi bilgiler ürünlerin, ambalajlarının üzerinde ya da kullanma talimatları içeriğinde görülebilecek.
Tıbbi Cihaz Etiketleme Şartları
Etiket bizatihi tıbbi cihazın ya da her kalemine ait dış ambalajının veya birden fazla tıbbî cihazın bir arada paketlendiği koliler üzerinde görülen yazılı, basılı ya da çizimsel bilgileri ifade eder. Üreticiler ürünlerinin etiketlerinde Yönetmeliğe aykırı bir durumu önlemek adına şu unsurların tamamının yer almasını sağlamak durumundadır:
- Ürün adı
- Ürünün lot veya seri numarası
- Kullanıcının cihazı, ambalajı içeriklerini ve kullanım maksadını tanımlayıp saptayabilmesi için gereken her türlü bilgi
- Üretici irtibat bilgileri (yani, unvan ve adres)
- Üreticilerin AB dışında yerleşik olması durumunda, yetkili temsilcilerinin ad ve adresleri
- İlgisine göre, MDR Madde 10.4.5 uyarınca istenen bilgiler
- MDR Ek VII Kısım C dâhilinde bahsi geçen UDI (tekil kimlik numarası) başlığı
- Hususi saklama veya elleçleme koşulları sağlanması gerekiyorsa, buna ilişkin açık ve net bir ibare
- Cihazın güvenli kullanımına ilişkin süre sınırlaması varsa bu süreyi, yoksa, üretim tarihini belirten açık ve net bir ibare
- Ürünün steril bir durumda teslim edilip edilmediği, sterillik durumu ve sterilizasyon yöntemine ilişkin bir ibare
- Ürünün tek kullanımlık olup olmadığına ilişkin bir ibare
- Cihazın ısmarlama veya salt klinik araştırma amaçlı olup olmadığına dair bir ibare
- Acilen kullanıcı dikkate sunulması gereken, diğer uyarı ve alınması gereken önlemler
MDR İşlemleri için Biz Zorluk: Tıbbi Cihazlar İçin Kullanım Kılavuzu Şartları
Kullanım talimatından kasıt, bir ürünün üreticisi tarafından bu ürünün öngörülen kullanım amacına uygun ve doğru kullanımı konusunda kullanıcıyı bilgilendirmek amacıyla verilen bilgidir. Kullanma talimatı beraberinde verilen bilgiler içeriğinde asgari şart olarak şunlar yer almalıdır:
- MDR Madde 23.2 (a), (c), (e), (f), (k), (l) ve (r) bentleri doğrultusunda istenen bilgiler;
- Cihazın öngörülen kullanım amacının ayrıntılı bir açıklaması
- Ürünün performans özellikleri
- İlgisine göre, beklenen klinik faydalara ilişkin bir açıklama
- Varsa artık riskler, kontrendikasyonlar ve istenmeyen yan etkilere ilişkin bir tarif
- Cihazın doğru kurulup kullanıldığını teyit için gerekli bilgiler.
- Steril ambalajda hasar olmamasını sağlamak üzere steril cihaz taşıma talimatları
- İlgisine göre, teslim edilen sterilizasyonsuz cihazların sterilizasyonu ile ilgili talimatlar
- Kullanım kılavuzu yayın tarihi
- Cihazın tıbbi amaçlarla radyasyon yayıp yaymadığı bilgisi
- Varsa özel tesis ihtiyaç ve cihaz kullanıcı vasıflarıyla ilgili şartlar
- Mükerrer kullanımlık cihazların mükerrer kullanımı temizliği, dezenfeksiyonu ve paketlemesi dâhil yeniden kullanımı sağlayıcı doğru süreçler hakkında bilgi
- Vücuda yerleştirilebilir ürünlerde, hataların maruz kalabileceği malzemelerin nitelik ve miktar bilgileri
- Tek kullanımlık cihazlarda, ürünün tekrar kullanılması hâlinde risk doğurabilecek bilinen karakteristik özellik ve teknik faktörler hakkında bilgiler.
- Varsa, tıbbi cihazın, aksesuarlarının ve varsa birlikte ya da içinde kullanılan sarf malzemelerinin güvenli bertarafını sağlayacak uyarı ya da önlemler.
- Bilgisiz, vasıfsız kullanıcının bir sağlık uzmanına danışmasını gerektiren durumlar.
Hangi Ürünler MDR İşlemlerinde Düzenleme Gerekliliklerini Karşılamalı?